Escrito por Tianna DuPont, David Granatstein y Bernardita Sallato, WSU Extension. Octubre 2018. Traducido por Melba Salazar, Marzo 2020.
La salud del suelo, o calidad del suelo, es la capacidad del suelo para soportar árboles productivos a través del tiempo sin afectar negativamente el medio ambiente circundante. La salud del suelo está influenciada por la interacción de sus propiedades biológicas, físicas y químicas. Las comunidades biológicas del suelo mineralizan el nitrógeno, crean la estructura del suelo y compiten con los patógenos de las plantas. Las propiedades físicas del suelo determinan su capacidad para almacenar y liberar nutrientes; para facilitar la entrada de agua, su almacenamiento y movimiento; para proporcionar suficiente oxígeno para raíces y microorganismos; y para moderar el estrés ambiental. Los aspectos químicos de la salud del suelo se refieren a la presencia y disponibilidad de nutrientes, pH, capacidad de intercambio catiónico (CEC), salinidad y contaminantes como metales pesados o residuos de pesticidas.
Con el conocimiento y comprensión de las propiedades biológicas, físicas y químicas del suelo, podemos mantener la salud de las raíces, moderar el estrés hídrico y de nutrientes, y aumentar el potencial de rendimiento de nuestros huertos.
Funciones proporcionadas por suelos sanos
Salud de la raíz
El crecimiento y el desarrollo de la raíz están controlados por múltiples factores, como los microorganismos del suelo, el oxígeno, la temperatura del suelo, la disponibilidad de agua, los nutrientes y las prácticas de manejo (Atkinson y Wilson 1980).
Las grandes comunidades microbianas activas son importantes para reducir la presión de plagas y patógenos y mantener la salud de las raíces (Figura 1). Estas comunidades compiten por recursos y atacan directamente las plagas y patógenos (van Os y van Ginkel 2001; Garbeva, van Veen y van Elsas 2004). Por ejemplo, algunos grupos de microbios producen antibióticos (Streptomices y numerosas cepas de Micromonespora y Nocardia). Algunas cepas de Pseudomonas producen antibioticos para reducir la presión de patógenos. Otros microbios, como los hongos Trichoderma, parasitan activamente los patógenos de las plantas; se ha encontrado que suelos con mayor contenido de Trichodermas, y Streptomices, bacteria Pseudomonas, controlan mejor los patógenos causante de las enfermedades de la raíz que los suelos con niveles más bajos de estos microorganismos benéficos (Weerakoon et al. 2012).

Las raíces se desarrollan mejor en ambientes con suficiente oxígeno y temperaturas óptimas. Los investigadores han determinado que las temperaturas óptimas para las raíces de manzana son de 64 a 77°F. Las temperaturas del suelo por encima de 86°F son perjudiciales para las raíces (Gur, Bravdo y Mizrahi 1972). La tolerancia a la temperatura del suelo varía según la genética; por ejemplo, las raíces del portainjerto M.9 murieron a 77°F; a altas temperaturas, muchas raíces maduraron rápidamente, se quemaron, se desprendieron y fueron infectados por patógenos (Nelson y Tukey, 1955). Con una temperatura del suelo <59 ° F la brotación se retrasó y dio como resultado menos racimos de flores en “Braeburn” / M.9 (Greer et al. 2006). En Chile las temperaturas adecuadas para los portainjertos de las cerezas Gisela estuvieron entre 57°F y 83°F, por debajo de estas temperaturas no hubo crecimiento; sin embargo, las temperaturas óptimas para el crecimiento de las raíces varían de acuerdo con las regiones de crecimiento (Bonomelli et al. 2012).
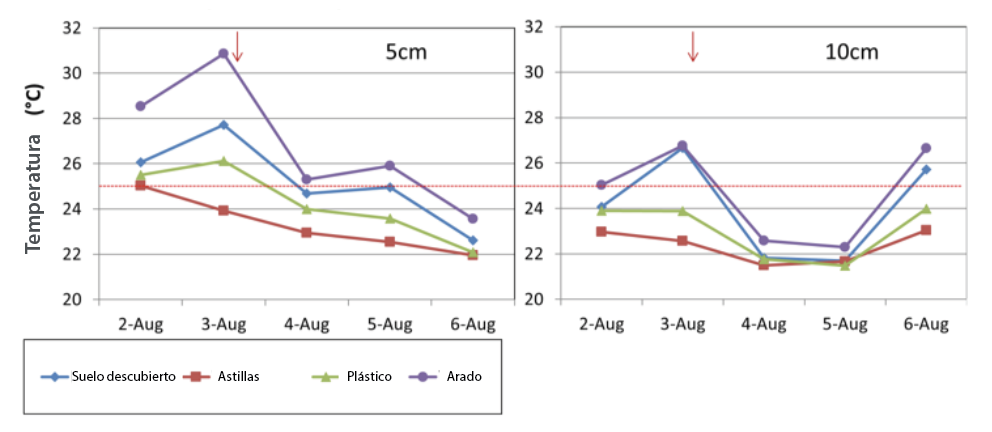
El manejo del suelo es importante para reducir la temperatura superficial del suelo y el estrés radicular en los veranos en el estado de Washington; por ejemplo, en un estudio reciente en el estado de Washington, las hileras de árboles con suelo desnudo o cubierto con plástico o manta negra tuvieron temperaturas superiores a las óptimas (más de 77oF (25oC) a 2.5 pulgadas (5 cm) (Figura 2). En contraste, los suelos con mulch de astillas de madera tenían temperaturas debajo del punto de estrés de 77oF (25oC).
Disponibilidad de nutrientes

La materia orgánica del suelo actúa como un banco de nutrientes. Las cargas negativas de materia orgánica permiten la adsorción de cationes del suelo. Los nutrientes catiónicos como el magnesio (Mg2+) se encuentran en estos sitios de intercambio, listos para ser disueltos en la solución del suelo para que las plantas los puedan absorber. Los exudados de raíz de las plantas ayudan a “diluir” los nutrientes en la solución al intercambiar nutrientes; ejemplo, al absorber Mg hay liberación de Hidrógeno (H). Cuanto mayor es la capacidad de intercambio catiónico (CIC), más espacios de intercambio hay para los nutrientes del suelo, mejor retención y menor perdida por lixiviación (arrastre a capas profundas del suelo). En suelos de textura gruesa como la arena, la materia orgánica es lo que le otorga la capacidad de intercambio catiónico al suelo (Figura 3).
La materia orgánica no solo almacena nutrientes, sino que también suministra nitrógeno a través de la mineralización. La materia orgánica contiene aproximadamente 5% de nitrógeno (N), y entre un dos a cuatro por ciento de ésta se mineraliza cada año. Por ejemplo, un suelo con tres por ciento de materia orgánica puede liberar 60 libras de nitrógeno por acre cada año.
La biota del suelo es otro regulador importante de la disponibilidad de nutrientes. Los nemátodos, protozoos y micro artrópodos que se alimentan de bacterias y hongos impactan significativamente la retención y liberación de nutrientes del suelo. Cuando la biota come bacterias, hongos o ambos, excreta nitrógeno en forma disponible para la planta, como el amoníaco (NH4-N). En suelos de pasturas, nematodos mineralizaron entre ocho y veintidós por ciento del nitrógeno disponible (Elliott, Hunt y Walter 1988). En otro estudio se liberaron 28 libras de nitrógeno por acre por año (Culman et al. 2010). La mesofauna, como los ácaros y los colémbolos que se alimentan de microbios, excretan desechos ricos en nitrógeno, esta mineralización puede contribuir hasta el 30% del nitrógeno suministrado por el suelo (Deruiter et al. 1993; Griffiths 1994), y aumentar la absorción de las plantas hasta en un 50% (Laakso, Setala y Palojarvi 2000). Adicionalmente, las micorrizas actúan para movilizar el fósforo y otros nutrientes haciéndolos fácilmente disponibles para las plantas (Jansa 2011).
Disponibilidad de agua

Los árboles necesitan suficiente agua para mantener el crecimiento, el rendimiento, el tamaño y la calidad del fruto (Naor et al., 1995). Los desórdenes relacionados con el calcio, como bitter pit (o depresion amarga) o cork spot (mancha corchosa) se han associado a excessos de riego (Kalcsits 2018; Tonetto de Freitas and Mitcham 2012, Brun, et. al. 1985).
El exceso de agua debido a un drenaje deficiente, o el encharcamiento causado por el enfriamiento continuo, puede estimular la proliferación de patógenos y propiciar condiciones anaeróbicas que interrumpen la función de la raíz y también pueden causar pérdida de nutrientes a través de la desnitrificación o la lixiviación. Los suelos con baja densidad aparente, bien estructurados y alta porosidad tienen mejor drenaje (Figura 4).
La estructura del suelo y su calidad moderan la disponibilidad de agua para la planta. La materia orgánica del suelo actúa como una esponja que retiene el agua del suelo y con el tiempo la libera lentamente a las plantas (por ejemplo, Figura 3). Cuando aumenta la materia orgánica del suelo, aumenta la capacidad de agua disponible; Según Hudson (1994), la capacidad de retención de agua aumentó de cinco a veinticinco por ciento (peso volumen) a medida que la M.O aumentó de 0.5 % a 3 %. El efecto en el aumento de agua disponible con MO es mayor para suelos arenosos, pudiendo ser insignificante en suelos arcillosos (Minasny and Mcbratney 2018). Otros indicadores de calidad del suelo, como la compactación, tienen un gran impacto en la disponibilidad del agua para las raíces (Mathers 2004). Los colchones superficiales ayudan a reducir la pérdida de agua por evaporación del suelo y pueden reducir los períodos de estrés hídrico, así como el uso general del agua (Granatstein and Mullinix, 2008).
Relación entre calidad y rendimiento del suelo
Se ha demostrado que los suelos saludables soportan rendimientos más grandes y más estables (Pimentel et al. 2005, Chivenge, Vanlauwe, and Six 2011) (Figure 5). Sin embargo, se necesita mucha más investigación sobre esta relación en los sistemas de cultivo de huertos. A continuación, se detalla el efecto de diferentes investigaciones en la MO de los suelos.
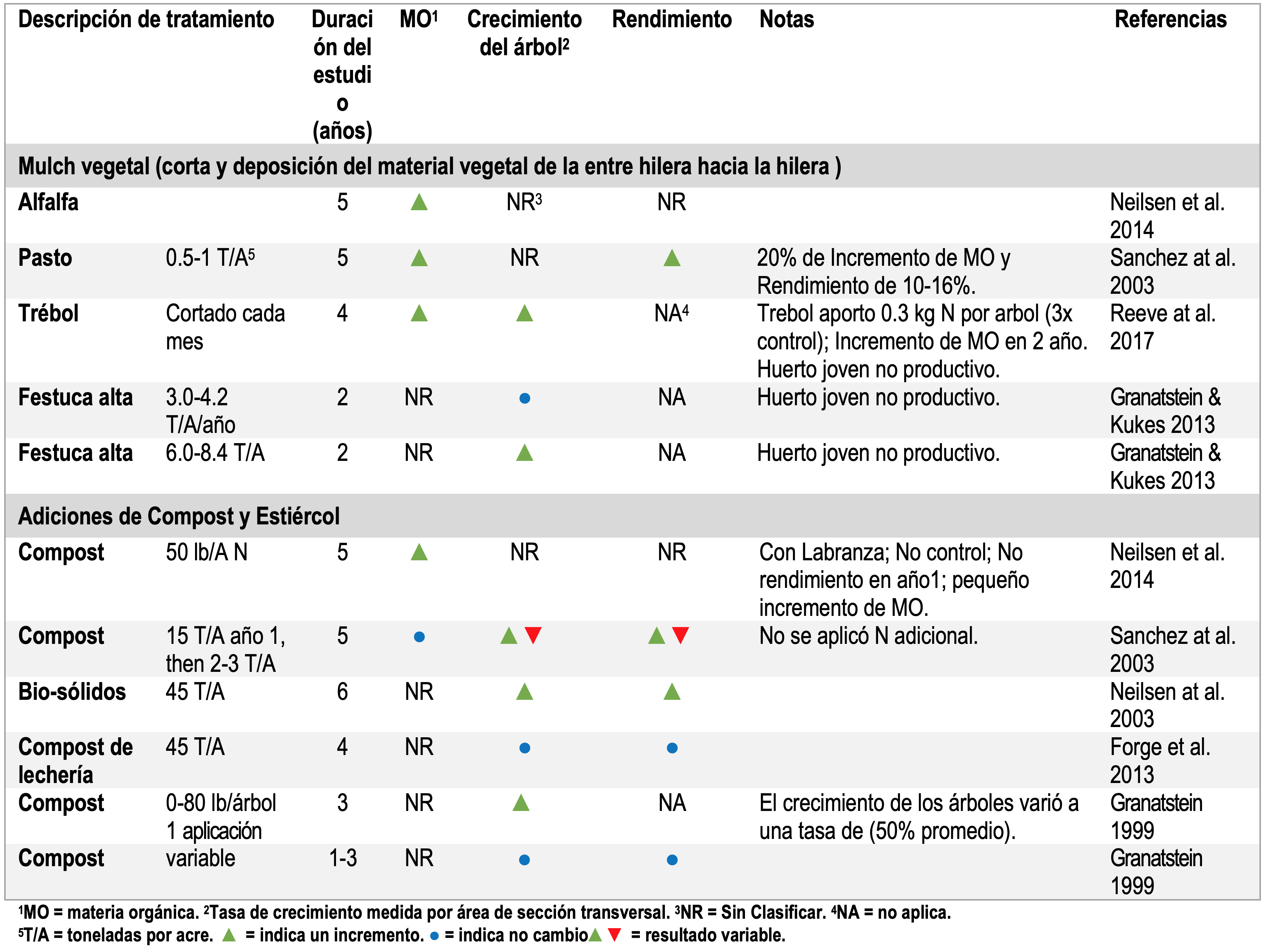
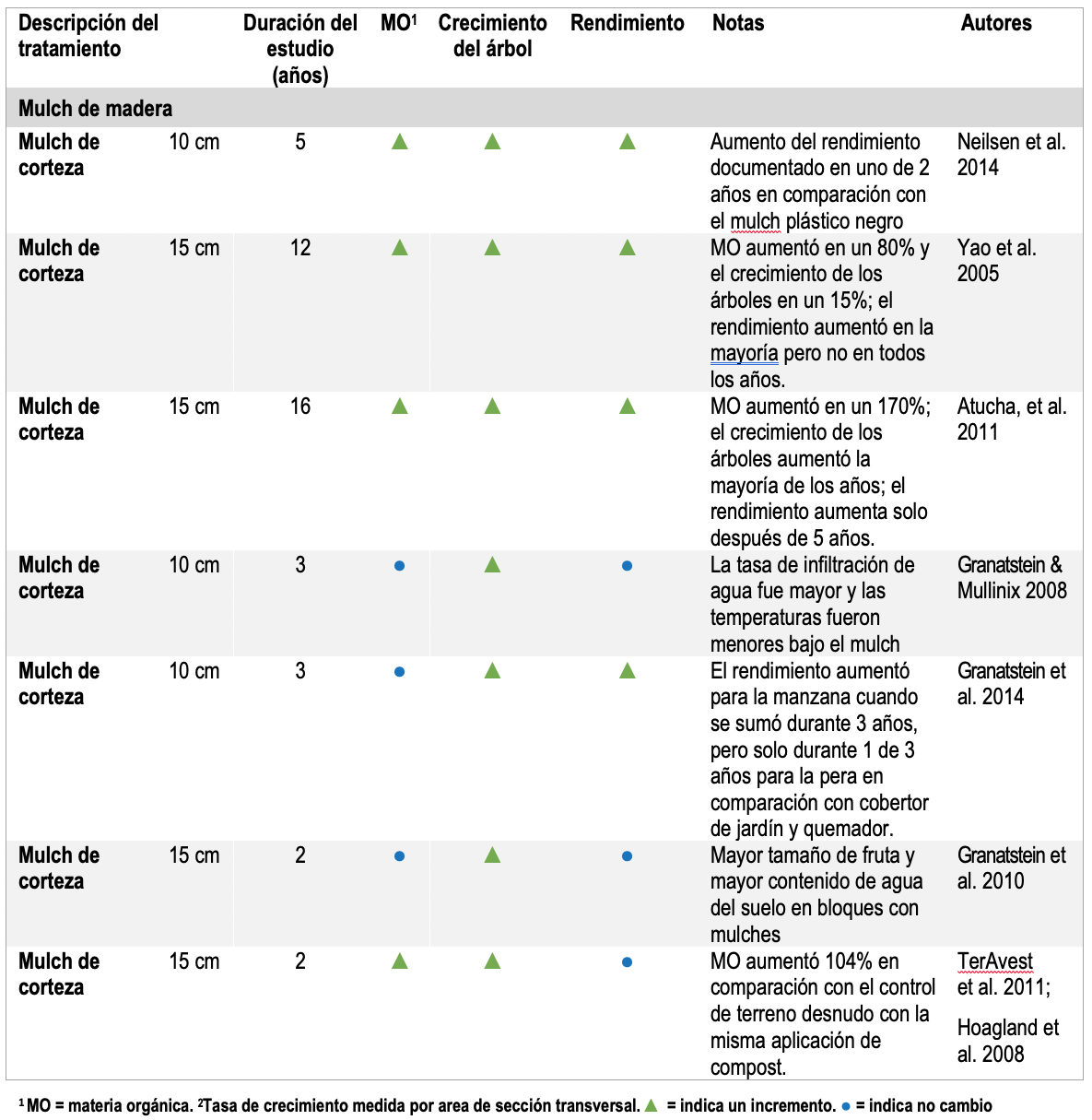
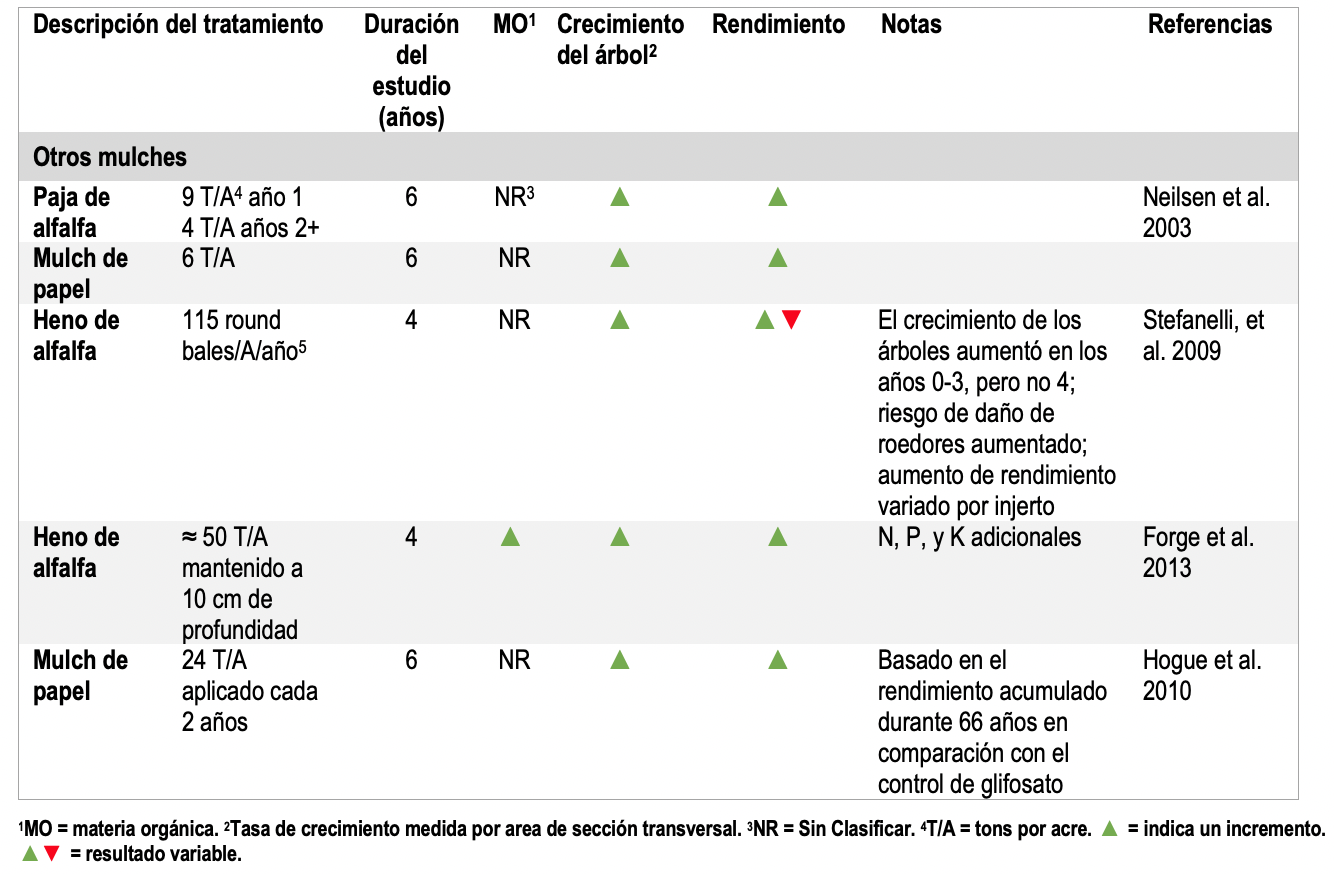
Altos niveles de MO aumentan el rendimiento y el crecimiento de árboles (Tablas 1-3) (Neilsen et al. 2014; Yao et al. 2005; Atucha, Merwin, and Brown 2011; Sanchez et al. 2003; Reeve et al. 2017; TerAvest et al. 2011; Hoagland et al. 2008; Forge et al. 2013). En tres condiciones en las que no se logró aumentar la MO, no hubo cambios en el rendimiento o crecimiento de plas plantas (Neilsen et al. 2014; Sanchez et al. 2003).

Otros estudios indicaron crecimiento e incremento en rendimiento indicando que ni la MO ni otros indicadores de calidad del suelo se correlacionaron con el rendimiento (Hogue et al. 2010; Stefanelli, Zoppolo, and Perry 2009).
Tabla 1. Resumen de los estudios de manejo del suelo del huerto con compost, estiércol o adiciones de materia orgánica. Control de malezas en la hilera.
Estudios con mulch de astillas de madera
Los parámetros de calidad del suelo, como la capacidad de retención de agua del suelo, el ciclo de nutrientes y la actividad biológica pueden afectar el crecimiento y el rendimiento de los árboles, incluso cuando los niveles de materia orgánica del suelo no han cambiado (o aún no lo han hecho). Esto es evidente en varios estudios con mulch a base de astillas de madera donde el crecimiento y el rendimiento de los árboles mejoraron incluso cuando la materia orgánica del suelo no cambia de manera apreciable (Tabla 2). El mulch puede influir en la temperatura del suelo, en la disponibilidad del agua, los nutrientes y la actividad biológica. Por ejemplo, en un estudio de cuatro años en manzanos Red Delicious / M.26 cerca de Wenatchee, WA, el mulch de las virutas mejoró el crecimiento de los árboles, pero no el rendimiento en comparación con el uso del suelo desnudo (Tabla 2). El mulch no aumentó la MO del suelo, pero mejoró la mineralización biológica potencial de N (Granatstein and Mullinix, 2008). En un estudio relacionado en el mismo huerto, el mulch aumentó el crecimiento de los árboles y el tamaño de la fruta, pero no el rendimiento o el carbono activo después de tres años (Granatstein et al. 2010). En otro estudio, en el centro de WA, el mulch condujo a un mayor crecimiento de los árboles y el rendimiento en comparación con la labranza en un huerto orgánico maduro Gala / M.26 (Granatstein et al. 2014). En un huerto de manzanos recién plantado, el mulch mejoró el crecimiento y el rendimiento de los árboles durante tres años; el C y N total del suelo en este huerto aumentó lentamente y las diferencias entre tratamiento solo se hicieron aparentes en el tercer año (Hoagland et al. 2008; TerAvest et al. 2011).
Table 2. Resumen de los estudios de manejo del suelo del huerto utilizando mantillo de astillas de madera. Mulch de chips de madera.
Table 3. Resumen de los estudios de manejo del suelo del huerto utilizando no leñosos mulches.
Estudios con Mulches vivos
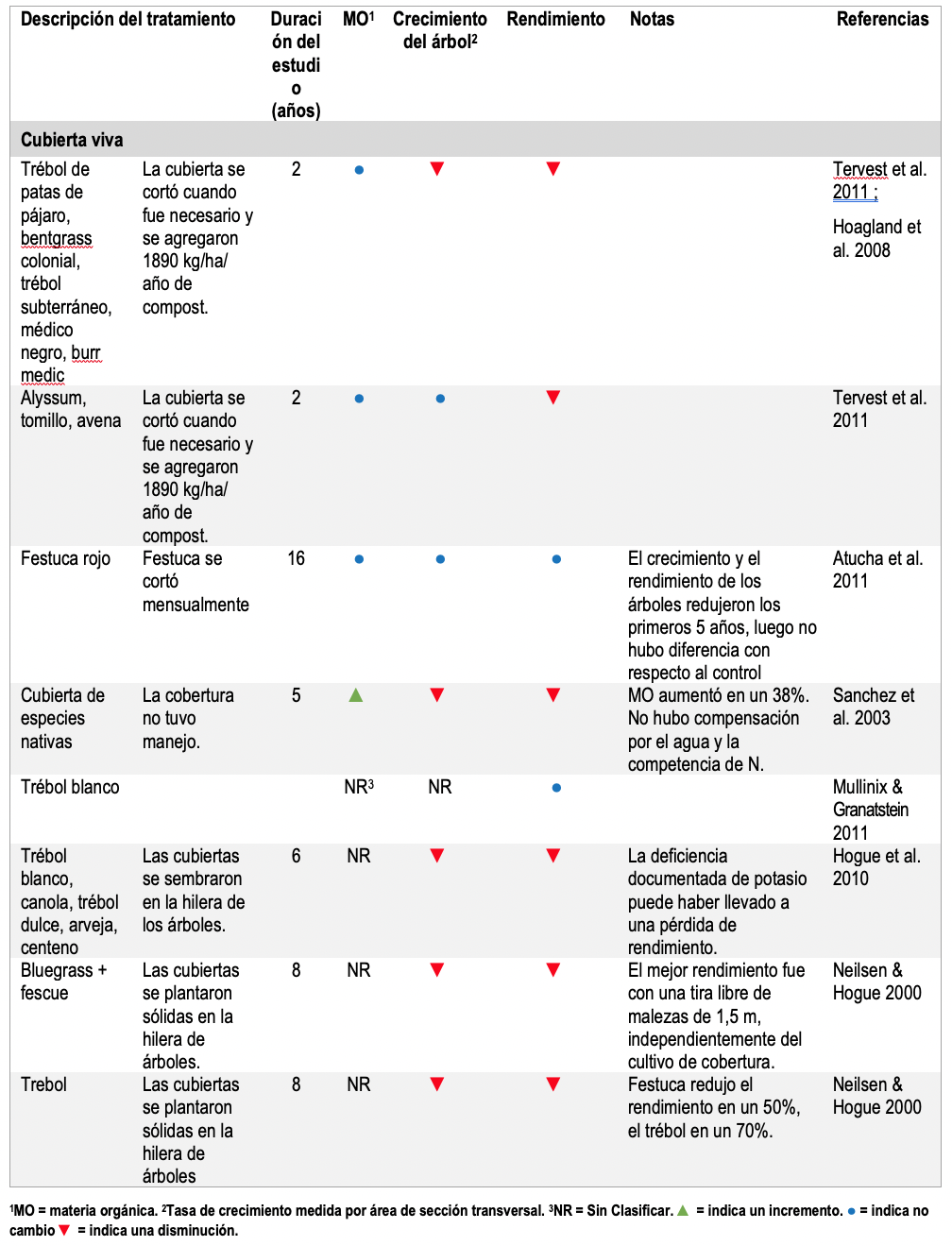
En la mayoría de los estudios de acolchado vivo donde la hierba, la leguminosa o la hierba se plantó en tanto en los surcos de los árboles como en las calles o entre surcos, el crecimiento y el rendimiento de los árboles fueron más bajos que el manejo a suelo desnudo (Tabla 4). La única excepción notable fue un estudio de dieciséis años en Nueva York en el que se cortaba festuca cultivada en hileras de árboles mensualmente. Si bien el crecimiento de los árboles se redujo durante los primeros tres años después de que se implementó una cubierta viva, con el tiempo el crecimiento y el rendimiento de los árboles fueron tan altos como el control, lo que sugiere que los árboles pudieron adaptarse a la paja del césped al desarrollar estructuras de raíces más profundas capaces de acceder al agua y nutrientes por debajo de las raíces de la hierba (Atucha, Merwin, and Brown 2011).
Table 4. Resumen de los estudios con cobertura viva.
Indicadores de salud del suelo
Actualmente se está investigando para determinar que indicadores de salubridad del suelo son más importantes para los huertos. Varios indicadores de importancia potencial incluyen la compactación del suelo, la capacidad de retención de agua, la infiltración de agua, la materia orgánica, la biota del suelo, el pH del suelo y los nutrientes del suelo.
Compactación del Suelo

El suelo productivo tiene suficiente espacio poroso lleno de aire y agua (aproximadamente 50% de partículas de suelo y 50% de espacio de poro) para mantener las raíces sanas (Brady 1996). El uso de equipo pesado en un suelo demasiado húmedo puede acercar las partículas del suelo, compactando físicamente el suelo, dejando poros más pequeños con menos aire y agua para las plantas (Duiker, 2004). Cuando el suelo está altamente compactado, las raíces ya no pueden penetrar, lo que restringe su crecimiento, el acceso al agua y a los nutrientes en estas capas del suelo (Figura 6).
La compactación no solo afecta el crecimiento de las raíces, sino que también reduce el volumen del espacio poroso y, en consecuencia, oxígeno en el suelo que puede estresar las raíces de las plantas.
Medición de la compactación del suelo: Un penetrómetro mide la fuerza requerida para presionar una varilla de metal en el suelo. La compactación de más de 300 psi puede restringir el crecimiento de la raíz.
Manejo de la compactación del suelo: Reducir el tráfico, aflojar mecánicamente con una herramienta de extracción profunda durante la renovación del huerto, plantar cultivos de cobertura con raíces principales fuertes que penetran en las capas de compactación y las adiciones de materia orgánica pueden reducir la compactación. Tenga en cuenta que la extracción profunda solo puede mitigar la compactación durante uno o dos años si no se combina con adiciones de materia orgánica y reducciones en tráfico.
Capacidad de retención de agua
La capacidad del suelo para retener agua y suministrarla lentamente a través del tiempo es crítica para limitar el estrés de la planta. La capacidad de retención de agua es la cantidad de agua que el suelo puede retener entre la capacidad del campo y el punto de marchitez permanente. Un suelo que ha sido completamente saturado por una fuerte lluvia o por un riego prolongado, se le permite drenar, pero no secar está a capacidad de campo. El punto de marchitez permanente se define como el nivel de humedad del suelo en el que una planta marchita no puede recuperarse incluso después de 12 horas en un suelo rehumedecido. Los suelos con niveles más altos de arcilla u materia orgánica tienen mayor capacidad de retención de agua que los suelos arenosos.
Cómo mejorar la capacidad de retención de agua del suelo: Las aplicaciones de estiércol, compost y cultivos de cobertura agregan materia orgánica a los suelos y pueden aumentar lentamente la capacidad de retención de agua del suelo.
Medición de la capacidad de agua disponible: La capacidad de agua disponible se determina calculando la diferencia del contenido de agua a capacidad de campo y el punto de marchitez permanente en laboratorio. Esto se realiza midiendo el contenido de agua en el suelo a diferentes presiones para simular la capacidad de campo (presión negativa pequeña) y el punto de marchitez permanente (presión negativa grande). La cantidad de agua retenida entre los extremos es la cantidad de agua disponible (Gugino, 2007).
Infiltración de agua

El movimiento del agua hacia y a través del suelo es crítico para asegurar que el agua llegue a las raíces de las plantas y no se lave la superficie del suelo o estanque (creando áreas anaeróbicas donde las raíces de las plantas no pueden respirar). Un buen movimiento del agua también ayuda a garantizar que los nutrientes solubles en agua se muevan a través del suelo hacia la zona de enraizamiento para que los árboles lo absorban. La tasa de infiltración está determinada en gran medida por el tamaño de los poros en la superficie del suelo. El agua se infiltra más rápido en las superficies del suelo con espacio poroso grande que los suelos con espacio poroso pequeño; los poros grandes, conocidos como macroporos, en la superficie del suelo, son especialmente importantes para aumentar las tasas de infiltración. Si bien los cultivadores no pueden cambiar la textura del suelo en un sitio determinado, las adiciones de materia orgánica al suelo pueden aumentar el tamaño de los poros y, por lo tanto, mejorar la estructura del suelo y el movimiento del agua. Es importante minimizar el tráfico en suelos húmedos que pueden comprimir los suelos y reducir la infiltración. Las raíces de los cultivos de cobertura en las calles y agujeros de lombrices de tierra también pueden crear macroporos que aumentan la infiltración. En suelos arenosos como los huertos de Washington, la infiltración / drenaje también puede ser excesivamente alta.
Medición de la infiltración de agua: La tasa de infiltración es una medida de la cantidad de agua que puede infiltrarse en la superficie del suelo en un período de tiempo determinado. Una manera simple de medir la tasa de infiltración es insertar un anillo de plástico o metal en la superficie del suelo, agregar una cantidad determinada de agua y medir cuánto tiempo tarda el agua en infiltrarse en el suelo (Figura 7).
Materia Orgánica
La materia orgánica del suelo (MOS) son las fracciones “vivas, muertas y muy muertas” del suelo, incluidos los residuos frescos de plantas y animales, los microorganismos vivos y muertos, y los residuos bien descompuestos. Los residuos de cultivos, el estiércol, el compost y los residuos de cultivos de cobertura contribuyen todos a la MOS en los sistemas agrícolas.
¿Por qué es tan importante la materia orgánica del suelo? Si bien el porcentaje de MOS en el suelo es pequeño (con un promedio de 1-6 por ciento en suelos agrícolas), influye en muchas propiedades y procesos (Figura 8). La fracción viva de la materia orgánica del suelo incluye bacterias, hongos, protozoos, lombrices de tierra e insectos diminutos. La biota del suelo compone aproximadamente el 15% de la materia orgánica total del suelo, con un peso de entre 2,000 y 30,000 libras por acre (Gugino 2007; Brady 1996). Esta fracción viva del suelo mineraliza el nitrógeno, mejora la estructura del suelo, ayuda a la descomposición y modera la presión de patógenos / plagas.
La fracción “muerta”, de materia orgánica del suelo compuesta de residuos de plantas y animales, tan pronto se adiciona se descompone fácilmente. La mayoría de la materia orgánica se descompone rápidamente en dióxido de carbono, agua y minerales. La materia orgánica fresca del suelo es importante porque proporciona los alimentos y, por lo tanto, energía (por ejemplo, a través de la respiración) para los organismos del suelo y nutrientes minerales para los cultivos. Los suelos con carbono agregado (a menudo llamado “activo”) tienen más carbohidratos y azúcares disponibles para los microbios del suelo. El carbón activo también a menudo sirve como un indicador temprano de los cambios en la materia orgánica total. Los suelos con la adición de carbono generalmente tienen redes alimenticias de suelo más grandes y más estables.
La otra fracción de la materia orgánica del suelo está protegida de la descomposición y puede representar aproximadamente el 70% del total de MOS en los suelos agrícolas.
Medición de materia orgánica: La materia orgánica total se mide por combustión. El carbono activo se puede medir de varias maneras, incluida la oxidación de permanganato de potasio; la materia orgánica también se mide por tamizado de partículas (Gugino 2007).
Presión del patógeno de la raíz

La presión del patógeno es un indicador importante de la salud de las plantas. La alta presión del patógeno indica que los organismos causantes de enfermedades están presentes y que los otros miembros de la comunidad microbiana no los suprimen. Una presión más baja indica que hay pocos patógenos presentes o que el resto de la comunidad microbiana puede evitar que colonicen con éxito las raíces. Para árboles frutales como la manzana, se puede medir mediante un bioensayo de raíz de donde las plántulas se cultivan en suelo pasteurizado y no pasteurizado durante seis semanas y se mide el crecimiento posterior (Figura 9).
Biota de suelo
El suelo es un elemento vivo. En un pie cúbico de suelo puede haber dos billones de bacterias, tres millas de hifas fúngicas, cuatro millones de protozoos, treinta mil nematodos y cientos de microartrópodos (Kounang and Pimentel 1998). Las grandes comunidades biológicas activas son esenciales para las plantas sanas.
Las lombrices de tierra y los insectos actúan como “ingenieros de ecosistemas” que mezclan el suelo y crean la estructura del suelo. Pequeños insectos rasgan y trituran hojas y otros materiales vegetales en pequeños trozos fácilmente descompuestos por bacterias y hongos. Las bacterias y los hongos ayudan a crear la estructura del suelo al unir las partículas del suelo en agregados con largas hifas fúngicas y sustancias pegajosas producidas por bacterias. Los gusanos microscópicos llamados nematodos, así como los protozoos y los diminutos colémbolos, consumen estas bacterias y hongos, excretando el nitrógeno disponible para las plantas.
Medición de la actividad biológica del suelo: Hay muchas formas de medir la actividad biológica del suelo. La respiración del suelo cuantifica la actividad metabólica de la comunidad microbiana en un momento determinado al capturar y cuantificar el dióxido de carbono producido por la respiración e indica la abundancia microbiana. Las enzimas del suelo se pueden medir para indicar la actividad biológica. Las nuevas pruebas genéticas pueden crear una “huella digital” de ADN del suelo y también indican qué organismos son más activos.
Aumento de la actividad biológica: El compost, el estiércol y los residuos de cultivos proporcionan materia orgánica y alimentos para la red alimentaria del suelo. Los materiales con alto contenido de lignina tienden a fomentar hongos que pueden descomponer el material difícil de digerir con enzimas como la quitinasa. Los materiales con alto contenido de nitrógeno o con un tamaño de partícula pequeño tienden a estimular las bacterias.
Para obtener información adicional, consulte la publicación Soil Biota in Orchards.
Nitrógeno microbiano disponible
El nitrógeno almacenado en la materia orgánica del suelo se hace disponible lentamente a través del tiempo debido a la actividad microbiana. La cantidad de nitrógeno almacenado en la materia orgánica del suelo y la actividad de las comunidades biológicas determinan la disponibilidad de nitrógeno de la planta.
Medición del nitrógeno microbiano disponible: Varias pruebas miden el nitrógeno microbiano disponible. El N potencialmente disponible se determina mediante reacciones de cloruro de potasio. (Clune et al.2016), y la mineralización potencial de N usa una muestra incubada (por ejemplo, incubación anaerobia de 7 días). El análisis de proteínas del suelo mide la fracción de la materia orgánica del suelo presente como proteínas o sustancias similares a proteínas. El contenido de proteínas como el nitrógeno orgánico, influye en la capacidad del suelo para hacer que el N esté disponible por mineralización. Se mide con tampón de citrato a alta temperatura y presión.
PH del Suelo
El pH se considera una propiedad maestra del suelo, ya que influye en muchos procesos químicos y biológicos. El uso de fertilizantes nitrogenados acidificantes, con el tiempo, puede reducir el pH. Cuando el fertilizante se enfoca en la hilera de árboles, pueden aparecer diferencias dramáticas en el pH entre la hilera de árboles y el callejón. Por ejemplo, el pH de los suelos 5 huertos en Okanagan Valley, BC El suelo de los huertos en la hilera de árboles fue 3.9-4.4 en la hilera de árboles (indeseable para el crecimiento de los árboles) versus 5.4-6.7 en el callejón (Ross, Hoyt, and Neilsen 1985). El pH bajo aumentó el aluminio intercambiable y las relaciones de cationes intercambiables. Encalado es la solución típica a este problema. El pH alto es común en los suelos de huertos del centro de Washington. Las aplicaciones de azufre pueden devolver el pH al rango óptimo de 6.0 a 6.5 para la fruta del árbol.
Mejorando la salud del suelo en huertos
Se necesita una investigación significativa para determinar las mejores prácticas para mejorar la salubridad del suelo en los huertos. Los siguientes son principios básicos basados en el conocimiento actual.

Alimentar el suelo
El paso más importante para mejorar la salud del suelo en los huertos es promover el “ciclo del carbono” en la zona de las raíces de los árboles reciclando mejor las podas y las hojas, cortando y soplando tiras de hierba sobre la hilera de árboles (cortar y soplar), aplicando mantillos orgánicos, aplicando compost y otras fuentes de materia orgánica (Figura 10). Una aplicación constante de los aportes de carbono a lo largo del tiempo mejora la capacidad del suelo para retener y reciclar el agua y los nutrientes, combatir los invasores de patógenos y proporcionar un entorno radicular beneficioso. Las prácticas como el acolchado y la recolección de la vegetación del callejón sobre la hilera de los árboles pueden proporcionar un gran aislamiento del agua y la temperatura y proporcionar insumos de carbono que estimulan la salubridad del suelo.
Considere mulches leñosos
Los mulch leñosos han mostrado consistentemente sus bondades para mejorar el crecimiento y el rendimiento de los árboles probablemente debido a su capacidad para moderar el agua del suelo y el estrés por temperatura de los árboles (Figura 11). Si bien la importación de material astillado leñoso es costosa, considere opciones como las chipeadoras que pueden cortar las podas en el lugar, ahorrando mano de obra en la eliminación de material y proporcionando fuentes de carbono en el sitio. Mueva el material cortado a la hilera de árboles con un rastrillo u otra herramienta para colocarlo donde sea más útil.

Minimiza las molestias
En general, los huertos se destacan por minimizar la alteración del suelo. La mayoría de los huertos tienen labranza en un solo punto durante su vida, en el momento de la siembra. Esto puede involucrar rasgaduras profundas en el suelo para ayudar a aliviar la compactación (una adición para la calidad del suelo), cultivar la hilera de árboles para incorporar fertilizantes o enmiendas, y preparar un semillero en la calle para el cultivo de cobertura.
La alteración mínima ayuda a mantener la estructura del suelo y las redes fúngicas, y minimiza la oxidación de la materia orgánica. Mantenga residuos en la superficie del suelo para protegerlo contra la erosión del suelo. En huertos orgánicos, la labranza puede usarse varias veces al año para el control de malezas en la hilera de árboles. El riesgo de erosión es mínimo debido a callejones con vegetación. Algunos cultivadores usan la labranza durante los años de establecimiento de los árboles y luego dejan que la vegetación se mueva hacia la hilera de árboles que controlan con la segmentación, la combustión o los herbicidas orgánicos.
Raíces vivas
La mayoría de los huertos modernos tienen vegetación perenne en la calle, típicamente una mezcla de hierba. Por lo tanto, la mitad o más de la superficie del suelo tiene cobertura permanente durante todo el año, lo que es excelente para el control de la erosión, la estructura del suelo, la infiltración de agua y el suministro de carbono al suelo a través de exudados de raíces, raíces moribundas y recortes en descomposición. Las hileras de árboles que quedan desnudas por el tratamiento repetido con herbicidas en algunos casos muestran pérdida de estructura e infiltración de agua.
No olvides el pH y los nutrientes.
La salubridad del suelo tiene que ver con las propiedades químicas, físicas y biológicas del suelo. Si bien ampliamos nuestra consideración de la salubridad del suelo al incluir propiedades biológicas y físicas, no podemos olvidar monitorear y manejar los principales nutrientes y micronutrientes.
Resumen
La disponibilidad de agua y nutrientes y las raíces saludables son esenciales para optimizar la calidad y productividad de la fruta. Una mayor comprensión de las propiedades biológicas, físicas y químicas del suelo puede mejorar la capacidad del cultivador para mejorar estas funciones esenciales del suelo en los huertos.
Pruebas comerciales de salud del suelo
Para obtener una base de datos de laboratorios certificados, visite http://analyticallabs.puyallup.wsu.edu/
- A&L Western Laboratories http://www.al-labs-west.com/ Lleva a cabo pruebas de nutrientes y análisis de nematodos.
- AgSource Laboratories Umatilla, OR. 509-727-6058 www.agsource.com Ofrece dos paquetes de salud del suelo que miden los nutrientes del suelo, así como la materia orgánica y la respiración microbiana.
- Best-Test Analytical Services, LLC Moses Lake, WA. 509-766-7701 www.besttestlabs.com Proporciona pruebas de nutrientes del suelo y materia orgánica.
- Brookside Laboratories, Inc. New Knoxville, OH. 419-753-2448 www.blinc.com Proporciona una prueba de salud del suelo que incluye respiración microbiana por medición de Solvita, carbono y nitrógeno extraíbles en agua, y nitrógeno orgánico disponible, así como análisis de nutrientes estándar.
- Cornell http://soilhealth.cals.cornell.edu/ Ofrece propiedades biológicas, físicas y químicas de las pruebas de suelo, incluyendo pH del suelo, materia orgánica, P modificado extraíble de Morgan, K, micronutrientes, textura del suelo, carbono activo, estabilidad de los agregados húmedos, suelo respiración, proteína extraíble, capacidad de agua disponible, sales solubles, bioensayo de salud de raíces y nitrógeno potencialmente mineralizable. Nota: Se recomienda la extracción de Olsen (P y K) en Central Washington.
- Dellavalle Laboratory, Inc. Fresno, CA 800 228-9896 www.dellavallelab.com Proporciona análisis de nutrientes y nematodos del suelo.
- Northwest Agricultural Consultants Inc. Kennewick, WA 509-783-7450 www.nwag.com Offer soil nutrient analysis, Haney test, organic matter, and nematode analysis.
- Oregon State University https://agsci.oregonstate.edu/central-analytical-laboratory/soil-health-initiative Ofrece propiedades biológicas, físicas y químicas de las pruebas del suelo, incluyendo pH del suelo, materia orgánica, análisis de nutrientes, micronutrientes, textura del suelo, activo carbono, estabilidad del agregado húmedo, respiración del suelo, proteína extraíble, capacidad de agua disponible, sales solubles y nitrógeno potencialmente mineralizable.
- Soiltest Farm Consultants Moses Lake, WA. 509-765-1622 soiltestlab.com Ofrece análisis de nutrientes y nematodos, así como respiración del suelo y carbón activo.
Recursos Adicionales
- Brady, N. C., and R. R. Weil. The Nature and Properties of Soils. 11th ed. Upper Saddle River, N.J.: Prentice Hall, 1996.
- Doran, J. W., D.C. Coleman, and D.F. Bezdicek (eds). 1994. Defining Soil Quality for a Sustainable Environment. Madison, WI: Soil Science Society of America. doi: 10.2136/sssaspecpub35.frontmatter.
- Duiker, S.W. 2002. Diagnosing Soil Compaction Using a Penetrometer (Soil Compaction Tester). University Park: Agronomy Facts 63, Penn State Extension.
- Magdoff, F., and H. M. van Es. 2009. Building Soils for Better Crops. Beltsville, MD: Sustainable Agriculture Research and Education Program.
- USDA Natural Resources Conservation Service. Indicadores de Calidad del Suelo: Químicos y Funciones del Suelo.
- USDA Natural Resources Conservation Service. Indicadores de Calidad del Suelo: Biológicos y Funciones del Suelo.
- USDA Natural Resources Conservation Service. Hoja de Informacíon de Calidad del Suelo: Introducción.
Agradecimientos
Parte de este documento ha sido Publicado previamente a https://extension.psu.edu/soil-quality, DuPont, S. T., 2012. Soil Quality Information. Penn State Extension EE0040.
Referencias
Atkinson, D. and S.A. Wilson. 1980. The growth and distribution of fruit tree roots: some consequences for nutrient uptake. In Mineral Nutrition in Fruit Trees. Edited by D. Atkinson, J.E Jackson, R.O. Sharples and W.M. Waller. London: Butterworth. pp. 137-150.
Atucha, A., I. A. Merwin, and M. G. Brown. 2011. Long-term effects of four groundcover management systems in an apple orchard. Hortscience 46 (8):1176-1183.
Bonomelli, C., C. Bonilla, E. Acuna, and P. Artacho. 2012. Seasonal pattern of root growth in relation to shoot phenology and soil temperature in sweet cherry trees (Prunus avium): A preliminary study in central Chile. Ciencia e Investigacion Agraria 39 (1):127-136.
Brun, C.A., J.T. Raese, and E.A. Stahly. 1985. Seasonal response of ‘Anjou’ pear trees to different irrigation regimes. II. Mineral composition of fruit and leaves, fruit disorders, and fruit set. J. Am. Soc. Hortic. Sci. 110:835-840.
Chivenge, P., B. Vanlauwe, and J. Six. 2011. Does the combined application of organic and mineral nutrient sources influence maize productivity? A meta-analysis. Plant Soil 342 (1-2):1-30. doi: 10.1007/s11104-010-0626-5.
Culman, S. W., S. T. DuPont, J. D. Glover, D. H. Buckley, G. W. Fick, H. Ferris, and T. E. Crews. 2010. Long-term impacts of high-input annual cropping and unfertilized perennial grass production on soil properties and belowground food webs in Kansas, USA. Agric. Ecosyst. Environ. 137 (1-2):13-24. doi: 10.1016/j.agee.2009.11.008.
de Freitas, S.T., and E.J. Mitcham. 2012. Factors involved in fruit calcium deficiency disorders. In Horticulture Reviews. Edited by J. Janick. Berkely: Wiley. doi: 10.1002/9781118351871.ch3
Deruiter, P. C., J. A. Vanveen, J. C. Moore, L. Brussaard, and H. W. Hunt. 1993. Calculation of nitrogen mineralization in soil food webs. Plant Soil. 157 (2):263-273.
Duiker, S. W. 2004. Effects of soil compaction. Penn State Extension (ed.). University Park: Penn State University.
Elliott, E. T., H. W. Hunt, and D.E. Walter. 1988. Detrital foodweb interactions in North-American grassland ecosystems. Agric. Ecosyst. Environ. 24:41-56.
Forge, T., G. Neilsen, D. Neilsen, E. Hogue, and D. Faubion. 2013. Composted dairy manure and alfalfa hay mulch affect soil ecology and early production of ‘Braeburn’ apple on M.9 rootstock. Hortscience 48 (5):645-651.
Garbeva, P., J. A. van Veen, and J. D. van Elsas. 2004. Microbial diversity in soil: Selection of microbial populations by plant and soil type and implications for disease suppressiveness. Annu. Rev. Phytopathol. 42:243-270. doi: 10.1146/annurev.phyto.42.012604.135455.
Granatstein, D. 1999. Compost effects on apple tree growth. The Compost Connection 1 (10).
Granatstein, D., P. Andrews, and A. Groff. 2014. Productivity, economics, and fruit and soil quality of weed management systems in commercial organic orchards in Washington State, USA. Organic Agriculture 4:197-207.
Granatstein, D., and A. Kukes. 2013. Mow and blow trial, Larson block, WMO, Quincy, WA. Unpublished data. Washington State University.
Granatstein, D., and K. Mullinix. 2008. Mulching options for northwest organic and conventional orchards. Hortscience 43:45-50.
Granatstein, D., M. Wiman, and E. Kirby. 2010. Sustainability trade-offs in organic orchard floor management. Proc. Organic Fruit. Acta Hort. 873.
Greer, D. H., J. N. Wunsche, C. L. Norling, and H. N. Wiggins. 2006. Root-zone temperatures affect phenology of bud break, flower cluster development, shoot extension growth and gas exchange of ‘Braeburn’ (Malus domestica) apple trees. Tree Physiology 26 (1):105-111.
Griffiths, B. S. 1994. Microbial feeding nematodes and protozoa in soil: Their effects on microbial activity and nitrogen mineralization in decomposition hot spots and the rhizosphere. Plant Soil 164 (1):25-33.
Gugino, B.K., O.J. Idowu, R.R. Schindelbeck, H. M. van Es, D.W. Wolf, B.N. Moebius, J.E. Theis, and G.S. Abawi. 2007. Soil Health Training Manual. Ithica: Cornell University.
Gur, A, B Bravdo, and Y Mizrahi. 1972. Physiological responses of apple trees to suboptimal root temperature. Physiol. Plant. 27 (2).
Hoagland, L., L. Carpenter-Boggs, D. Granatstein, M. Mazzola, J. Smith, F. Peryea, and J. P. Reganold. 2008. Orchard floor management effects on nitrogen fertility and soil biological activity in a newly established organic apple orchard. Biol. Fertil. Soils 45 (1):11-18. doi: 10.1007/s00374-008-0304-4.
Hogue, E. J., J. A. Cline, G. Neilsen, and D. Neilsen. 2010. Growth and yield responses to mulches and cover crops under low potassium conditions in drip-irrigated apple orchards on coarse soils. Hortscience 45 (12):1866-1871.
Hudson, B. D. 1994. Soil organic-matter and available water capacity. J. Soil Water Conserv. 49 (2):189-194.
Jansa, J. 2011. Role of mycorrhizal symbioses in phosphorus cycling. In Phosphorus in Action: biological processes in soil phosphorus cycling. E. Bünemann, A. Oberson and E. Frossard (eds.). Soil Biology Vol. 26. New York: Springer.
Kounang, N, and D. Pimentel. 1998. Ecology of soil erosion in ecosystems. Ecosystems 1 (5):416-426.
Laakso, J., H. Setala, and A. Palojarvi. 2000. Influence of decomposer food web structure and nitrogen availability on plant growth. Plant Soil 225 (1-2):153-165.
Minasny, B., and A.B. Mcbratney. 2018. Limited effect of organic matter on soil available water capacity. Eur. J. Soil Sci. 69:39-47.
Mullinix, K., and D. Granatstein. 2011. Potential nitrogen contributions from legumes in Pacific Northwest apple orchards. Intl. J. Fruit Sci. 11 (1):74-87.
Naor, A., I. Klein, and I. Doron. 1995. Stem water potential and apple size. J. Am. Soc. Hortic. Sci. 120 (4):577-582.
Neilsen, G. H., and E. J. Hogue. 2000. Comparison of white clover and mixed sodgrass as orchard floor vegetation. Can. J. Plant Sci. 80 (3):617-622.
Neilsen, G. H., E. J. Hogue, T. Forge, and D. Neilsen. 2003. Surface application of mulches and biosolids affect orchard soil properties after 7 years. Can. J. Soil Sci. 83 (1):131-137.
Neilsen, Gerry, Tom Forge, Denis Angers, Denise Neilsen, and Eugene Hogue. 2014. Suitable orchard floor management strategies in organic apple orchards that augment soil organic matter and maintain tree performance. Plant Soil 378 (1-2):325-335. doi: 10.1007/s11104-014-2034-8.
Nelson, E. H., and H.B. Tukey. 1956. Effects of controlled root temperatures on the growth of East Malling rootstocks in water culture. J. Hortic. Sci. 31 (1):55-63. doi: 10.1080/00221589.1956.11513857
Pimentel, D., P. Hepperly, J. Hanson, D. Douds, and R. Seidel. 2005. Environmental, energetic, and economic comparisons of organic and conventional farming systems. Bioscience 55 (7):573-582. doi: 10.1641/0006-3568(2005)055[0573:eeaeco]2.0.co;2.
Reeve, J.R. , C.M. Culumber, B.L. Black, A. Tebeau, C.V. Ransoma, D. Alstonc, M. Rowleya, and T. Lindstroma. 2017. Establishing peach trees for organic production in Utah and the Intermountain West. Sci. Hortic. 214:242-251.
Ross, G.J., P. B. Hoyt, and D. Neilsen. 1985. Soil chemical and mineralogical changes due to acidification in Okanogan apple orchards. Can. J. Soil Sci. 65:347-355.
Sanchez, J. E., C. E. Edson, G. W. Bird, M. E. Whalon, T. C. Willson, R. R. Harwood, K. Kizilkaya, J. E. Nugent, W. Klein, A. Middleton, T. L. Loudon, D. R. Mutch, and J. Scrimger. 2003. Orchard floor and nitrogen management influences soil and water quality and tart cherry yields. J. Am. Soc. Hortic. Sci. 128 (2):277-284.
Stefanelli, D., R.J. Zoppolo, and R. Perry. 2009. Organic orchard floor management systems for apple effect on rootstock performance in the midwestern United States. Hortscience 44 (2):263-267.
TerAvest, D., J.L. Smith, L. Carpenter-Boggs, D. Granatstein, L. Hoadland, and J. Reganold. 2011. Soil carbon pools, nitrogen supply, and tree performance under several groundcovers and compost rates in newly planted apple orchard. Hortscience 46 (12).
van Os, G. J., and J. H. van Ginkel. 2001. Suppression of Pythium root rot in bulbous Iris in relation to biomass and activity of the soil microflora. Soil Biol. Biochem. 33 (11):1447-1454. doi: 10.1016/s0038-0717(01)00053-0.
Weerakoon, D. M. N., C. L. Reardon, T. C. Paulitz, A. D. Izzo, and M. Mazzola. 2012. Long-term suppression of Pythium abappressorium induced by Brassica juncea seed meal amendment is biologically mediated. Soil Biol. Biochem. 51:44-52. doi: 10.1016/j.soilbio.2012.03.027.
Yao, S., I. A. Merwin, G. W. Bird, G. S. Abawi, and J. E. Thies. 2005. Orchard floor management practices that maintain vegetative or biomass groundcover stimulate soil microbial activity and alter soil microbial community composition. Plant Soil 271 (1-2):377-389. doi: 10.1007/s11104-004-3610-0.
Contacto
 Bernardita Sallato
Bernardita Sallato
Especialista en Extensión de Frutas
de Árbol Central sur
WSU-IAREC, Prosser
509-439-8542
b.sallato@wsu.edu
Los artículos de Fruit Matters solo pueden ser publicados nuevamente previa autorización del autor © Washington State University. La reproducción de los artículos permitidos deben incluir: Originalmente publicado por Washington State Tree Fruit Extension Fruit Matters en treefruit.wsu.edu y con link al articulo original.